医疗器械警戒快讯 2018年第6期
来源:
开云下载
发布时间:2024-08-13 00:26:03
美国FDA发布关于Maquet Datascope公司因可能在高海拔地区发生故障或失灵风险召回主动脉内球囊反搏泵(IABP)的警示信息
美国FDA发布关于Alcon Research公司因存在导致内皮细胞损失的风险召回微型支架系统的警示信息
美国FDA发布关于Roche Diagnostics公司因INR检测结果不准确风险召回凝血酶原时间检测卡(电化学法)的警示信息
加拿大Health Canada发布关于GE发布关于装饰性角膜接触镜风险的警示信息
美国FDA发布Pro-Med Instruments公司因也许会出现故障和失灵风险召回头部固定系统的警示信息
美国FDA发布关于Maquet Datascope公司因可能在高海拔地区发生故障或失灵风险召回主动脉内球囊反搏泵(IABP)的警示信息
召回级别:美国食品药品监督管理局(FDA)将本召回识别为I类召回,是最严重的召回类型。使用这些器械可能造成严重损伤或死亡。
ARTGCardiosave Hybrid和Cardiosave Rescue主动脉内球囊反搏泵(IABP)属心脏治疗辅助设备,用于心脏或非心脏手术中,也可用于急性冠脉综合征或心力衰竭伴并发症患者的治疗。
也可以改用Cardiosave CS100或CS300主动脉内球囊反搏泵,它们不受使用高度的影响。
此外,Maquet/Getinge公司正在研发一种软件修正方法,以便解决这一问题。Maquet/Getinge公司预计可在2019年2月推出这款升级软件。到时会有Maquet/Getinge公司的服务代表联系客户,商定日期后安装新软件。
美国FDA发布关于Alcon Research公司因存在导致内皮细胞损失的风险召回微型支架系统的警示信息
召回级别:美国食品药品监督管理局(FDA)将本召回识别为I类召回,是最严重的召回类型。使用这些器械可能造成严重损伤或死亡。
CyPass®系统适用于白内障手术,用于减低轻到中度成年原发性开角型青光眼患者的眼压。本器械的主要用户是眼科医生。CyPass®微型支架是一种带微孔的小管,用于通过手术植入到眼内。如果按照说明植入,该产品能起到给眼前房引流的作用,前房积液过多可导致青光眼患者眼压升高,视力受损。
Vyaire Medical, Inc2018年8月29日,Alcon Research, LTD发出了自愿将CyPass®微型支架退出全球市场的通告。公司称,该次自愿退市是基于COMPASS-XT长期安全性研究的五年术后数据。该项研究表明,与仅接受白内障手术的对照组相比,CyPass®微型支架植入组可观察到角膜内皮细胞损失增加,且具有临床和统计学意义。
Vyaire Medical, Inc根据对COMPASS-XT研究数据的初步审查结果,美国食品药品监督管理局发布了一封安全通告,告知医生和患者接受该器械植入存在眼睛受损的风险,建议医生们停用该器械。
Vyaire Medical, IncAlcon Research, LTD发出了“自愿退出医疗器械市场紧急通告”,告知医生们CyPass®微型支架存在导致内皮细胞损失的风险。通告就CyPass®微型支架系统提出了以下建议:
医生应立即停止植入CyPass®微型支架。通告指示用户清点未使用的CyPass®微型支架器械数量,并将未使用的器械返还给Alcon售后服务部门。
医生应对所有接受CyPass®微型支架植入的患者进行评估,确定术后该器械的位置(通过前房角镜检查法),并定期使用角膜内皮显微镜检查内皮细胞密度。
对于考虑术后不久(即术后一个月内)将该器械从患者眼内取出的医生,建议先采用侵入性较小的介入法(如位置调整或修整CyPass®微型支架的近端)来代替取出术。Alcon提醒称,修整对内皮细胞损失影响方面的临床数据目前很有限。医生应自行权衡潜在的获益和风险(加重内皮细胞损失)。
此外,通告中还提到,请医生将通告转发给所在医疗机构中所有可能保存有CyPass®微型支架器械的部门、所有护理CyPass®微型支架植入患者的医务人员以及该器械可能转运到的所有机构。
美国FDA发布关于Roche Diagnostics公司因INR检测结果不准确风险召回凝血酶原时间检测卡(电化学法)的警示信息
召回级别:美国食品药品监督管理局(FDA)将本召回识别为I类召回,是最严重的召回类型。使用这些器械可能造成严重损伤或死亡。
批号印刷于检测卡包装盒和检测卡小瓶的标签上。下图显示了批号在检测卡小瓶标签上的位置。

器械用途:凝血酶原时间检测卡(电化学法)与Roche INR凝血监测仪配合使用,用于监测患者对华法林(一种血液稀释剂,用于预防和治疗凝血块)的反应。将检测卡插入检测仪,然后采用医用穿刺针(采血针)采集血液并应用于检测卡。检测仪读取检测卡,测量凝血时间,并根据标准化计算以国际标准化比值(INR)的形式给出结果。患者和医生可通过INR确定华法林的剂量是否合适。
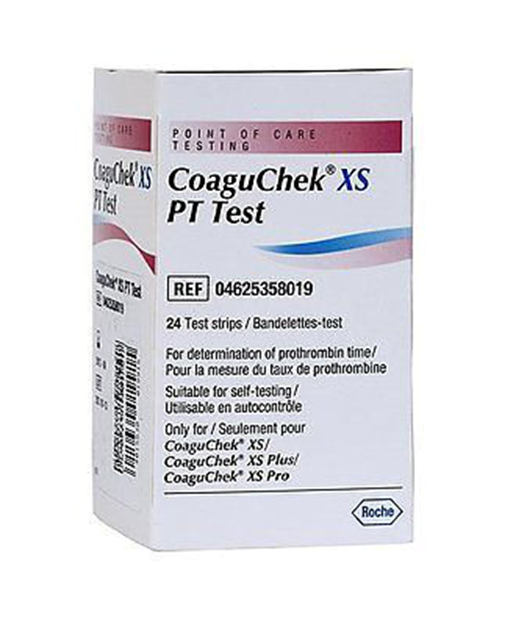
由于INR检测结果与实验室结果相比不准确,CoaguChek检测仪和检测卡的制造商Roche Diagnostics对凝血酶原时间检测卡(电化学法)进行召回。Roche于2018年1月对凝血酶原时间检测卡(电化学法)进行了重新校准,以符合新发布的INR国际标准。该次重新校准后,Roche Diagnostics收到相关患者报告,即采用下表中列出的受影响凝血酶原时间检测卡(电化学法)检测时出现异常升高或不准确的INR检测结果。
召回措施:患者和医务人员应当更换为校准至先前国际标准的新检测卡批次,Roche Diagnostics将在一个月内提供给客户。
患者也应当联系其患者自测服务提供者,以便了解他们将何时收到正确的检测卡。
使用此次召回涉及的CoaguChek检测仪和凝血酶原时间检测卡(电化学法)的患者,应当立即联系其医务人员和患者自测服务提供者,以便确定可替代的检测方法,并解决相关检测计划问题。
如有任何疑问,医务人员和患者可联系Roche Diagnostics,以了解有关召回的更多详细情况,联系电线-。
警示原因:随着万圣节临近,许多人开始考虑其服饰装扮,加拿大卫生部提醒消费者装饰性角膜接触镜可对健康造成风险。安全使用这种镜片至关重要。
装饰性角膜接触镜(有时候称作“时尚”、“装扮”、“美容”或“彩色”角膜接触镜)并不能矫正视力;它们可以改变眼球的外观。通常在服饰和新奇物品店、化妆品店以及在线销售。
角膜接触镜产生副作用(也被称作不良事件)的风险在吸烟者以及患有某些健康疾病(比如眼球感染或干眼症)的人群中更高。配戴未经许可的装饰性角膜接触镜的不良事件风险可能比经许可的处方角膜接触镜更高。
采取措施:为使得配戴装饰性角膜接触镜更加安全,加拿大卫生部于2016年开始将这些产品调整为医疗器械。这意味着在销售之前必须得到加拿大卫生部的许可。在加拿大销售未经许可的卫生产品属于非法行为。
加拿大卫生部许可的装饰性角膜接触镜均经过安全性、有效性和质量评估。配戴未经许可的装饰性角膜接触镜可能对您的健康造成风险。截止2018年10月,以下公司制造的装饰性角膜接触镜已经过加拿大卫生部的许可:
产品的许可状态经常变更。消费者可以通过包装上的产品名称和公司名称检索在线“Medical Devices Active Licence Listing”数据库,或者致电加拿大卫生部1-验证其装饰性角膜接触镜是否获得许可
如果您已经使用装饰性角膜接触镜并出现健康问题,请联系眼科护理专业人士。如果出现任何眼红、视力模糊、持续分泌物或对光敏感,请立即摘除镜片并联系眼科护理专业人士。如果不接受治疗,这些症状可能导致失明。
如果您在这次万圣节或者出于任何其它目的考虑配戴装饰性镜片,请联系眼科护理专业人士。这些专业人士可就适当角膜接触镜材料、验配设计,以及最适合眼球的护理方案提供相关的建议。
鼓励人们向加拿大卫生部报告涉及不合规行为的信息或配戴装饰性角膜接触镜的健康问题。
美国FDA发布Pro-Med Instruments公司因可能发生故障和失灵风险召回头部固定系统的警示信息
召回级别:美国食品药品监督管理局(FDA)将本召回识别为I类召回,是最严重的召回类型。使用这一些器械会造成严重损伤或死亡。
鼓励人们向加拿大卫生部报告涉及不合规行为的信息或配戴装饰性角膜接触镜的健康问题。
DORO Lucent Headrest System(DORO Lucent头部固定系统)用于在脑部和颈部手术时支撑头部(起到固定作用)。该头部固定系统包括几个部件,有基础单元、锁定转移部件和转移部件。
Pro-Med Instruments向受影响的客户发出了“产品安全通告”。通告给医护人员、零售商和分销商提供了以下建议:
确定购买过任何单一版本产品的客户,将本使用安全通告传达给他们,并将他们的联系方式告知Pro-Med Instruments公司。
确定拥有两种不同版本或购买过两种不同版本产品的客户,立即将他们的联系方式告知Pro-Med Instruments公司。
停止销售A版产品,并将所有含A版部件的产品(仅限库存)返还给Pro-Med Instruments公司。
Pro-Med Instruments公司将联系零售商和分销商,说明将问题产品从A版升级到B版。这些措施将防止以后把两种不同版本的部件混合使用,防止危险。